I.M.A.G.E.クローン:技術情報
□出荷と保存
クローンはスラント上での大腸菌培養物として、常温でお送りしています。お受け取り後は冷凍せず、4℃で保存して下さい。 受け取られましたら受け取られましたらできる限り早く同じ成分の培地に植菌して30℃で24時間培養し、シングルコロニーを回収してください。 10個以上のシングルコロニーそれぞれを、同じ抗生物質と8%グリセロールを含むLB液体培地にて培養した後、-70℃で保存してください。 こうして冷凍保存したクローンはプラスミド精製時に、再び培養することができます。
シングルコロニーを培養することはライブラリーを複製するのと同様、コンタミネーションやクロスコンタミネーション、オリジナルクローンの変異などが起きた場合に備えるために必要です。 シングルコロニーを多く培養しておけば、問題が起きた時に本来のクローンを手に入れられる可能性が高くなります。 この方法を使えばコンタミネーションを起こしているクローンから、本来のクローンを単離することもできます。
I.M.A.G.E.クローンはベクターの種類により抗生物質が異なります。詳しくはクローンに添付されるDatasheetをご覧ください。
データベースに公開されているI.M.A.G.E.クローンは、全てI.M.A.G.E. IDが使われています。 下記はSource BioScienceからの出荷書類(Despatch Note)の一例です。
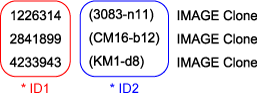
- * ID1:これがI.M.A.G.E. IDです。全てのデータベースの登録に使われています。
- * ID2:このIDは一般的には使われておりません。HGMP-RCがプレートを管理するために使っていたもので、スラントチューブなどに記入されています。
- 注意:CM=chloramphenicol耐性 KM=kanamycin耐性
未記入=ampicillin耐性
| 蓋の色 | 抗生物質 |
|---|---|
| Red | Ampicillin |
| Yellow | Kanamycin |
| Green | Carbenicillin |
| Blue | Chloramphenicol |
| Clear | Spectinomycin |
※:Slantでクローンをご注文の場合はI.M.A.G.E. IDのみを出荷書類の備考欄に記入しております。 抗生物質の種類は使われているスラントチューブ(2.0mlスクリューキャップチューブ)の蓋を色分けして判別できるようになっています。
□クローン受け取り後の処置について
使われている抗生物質によって異なります。どの抗生物質が使われているかはクローンIDで判別できます。
- □クローンID※がアルファベットで始まっていないもの(例:12226314/3083-n11)
- クローンはLB寒天培地(50?g/ml Ampicillin)にて培養されています。お受け取り後は冷凍せず、4℃で保存してください。 受け取られましたらできる限り早く同じ成分の培地に植菌して37℃で一晩培養し、シングルコロニーを回収してください。
- □クローンID※がCMで始まっているもの(例:2841899/CM16-b12)
- クローンはLB寒天培地(27?g/ml chloramphenicol)にて培養されています。お受け取り後は冷凍せず、4℃で保存してください。 受け取られましたらできる限り早く同じ成分の培地に植菌して30℃で24時間培養し、シングルコロニーを回収してください。
- □クローンID※がKMで始まっているもの(例:4233943/KM1-d8)
- クローンはLB寒天培地(100?g/ml kanamycin)にて培養されています。 お受け取り後は冷凍せず、4℃で保存してください。受け取られましたらできる限り早く同じ成分の培地に植菌して30℃で24時間培養し、シングルコロニーを回収してください。
※クローンIDはSource BioScienceが独自に割り振っているIDです。I.M.A.G.E. IDではありません。クローンIDはチューブに記入されています。
10個以上のシングルコロニーそれぞれを、同じ抗生物質と8%グリセロールを含むLB液体培地にて培養した後、-70℃で保存してください。 こうして冷凍保存したクローンはプラスミド精製時に、再び培養することができます。
シングルコロニーを培養することはライブラリーを複製するのと同様、コンタミネーションやクロスコンタミネーション、 オリジナルクローンの変異などが起きた場合に備えるために必要です。 シングルコロニーを多く培養しておけば、問題が起きた時に本来のクローンを手に入れられる可能性が高くなります。 この方法を使えばコンタミネーションを起こしているクローンから、本来のクローンを単離することもできます。
□受け取ったクローンが正しくないと思われる時は
私たちはSource BioScienceから、まれに配列の異なるI.M.A.G.E.クローンが頒布される場合があるとの報告を受けています。 もしお受け取りになったクローンが注文したものと異なる場合は私たちにご相談下さい。 こちらの手違いにより異なるクローンが送られていた場合、正しいクローンを再度お送り致します。
しかし、配列の異なるクローンが届いている時は再送を依頼される前に、注文したクローンのIDが間違ってなかったかどうか今一度お確かめ下さい。
ライブラリーは提供元で作製、または複製されておりますので、再送したクローンも正しいクローンでない場合は、残念ながらこちらで正しいクローンを準備することはできません。 また、返金もできませんのであらかじめご了承下さい。
このような危険性を回避されたい場合は、Sequence Verified Cloneを購入されることをお勧めいたします。 Sequence Verified Cloneは出荷前にSource BioScience社で末端配列の確認サービスを行っており、このようなエラークローンを受け取る危険性を抑えることができます。
※:製品一覧でSequence Verifiedの記述が無いクローンに対してはこのサービスを選択できない場合があります。
□推奨しているDNA単離、精製方法
□プラスミドDNA mini-prepの準備
通常のmini-prep法が適しています。Source BioScience社では下記の方法で行われています。
- 適切な抗生物質を含んだLB寒天培地の上にクローンを蒔き、一晩37℃(amp)または30℃(CM or KM)で培養する。
- LB培地5mlを滅菌済みの50mlチューブに分注し、適切な抗生物質を加える。その培地に単独のシングルコロニーを植菌し、一晩37℃(amp)または30℃(CM or KM)振とう培養する(170rpm)。
- [グリセロールストックを作製する場合は1.5mlマイクロチューブに140?lずつ分注し、40?lの80%グリセロールを加えて混合し、冷凍保存する]
- 2mlの培養液を2mlのマイクロチューブに移し、15分間3000rpmで遠心する。
- 上澄みを捨て、200?lのGTE溶液を加えペレットを懸濁させる。その後RNase A stock (10mg/ml)を5?l加え、10分間室温に放置する。
- 用事調製した0.2M NaOH/1% SDS溶液400?lを加え転倒撹拌した後、氷上に5分間放置する。
- 300?lの3M K Acを加え、転倒撹拌した後、氷上に10分間放置する。
- 10分間13000rpmで遠心し、上澄みを冷やしたエタノール1mlが入った1.5mlマイクロチューブに移す。その後、ボルテックスミキサーで軽く撹拌し、氷上に30分間放置する。
- 10分間13000rpmで遠心し、エタノールを注意深く取り除く(吸引法を用いるのが望ましい)。
- 冷やしたエタノールを200?l加え、ボルテックスミキサーで軽く撹拌した後、10分間13000rpmで遠心する。その後9.のようにエタノールを注意深く取り除く。
- ペレットを乾燥させた後、50?lのTEを加え、一晩4℃で保存する。
□溶液
- 10ml GTE:
- 0.5ml 20% glucose
- 0.25ml 1M Tris/HCl pH7.5
- 0.2ml 0.5M EDTA pH8.0
- 9.05ml 滅菌水
- 100ml 0.2M NaOH/1% SDS:
- 0.8 g NaOH
- 5ml 20% SDS
- 95ml 滅菌水
□プラスミドDNAのPEG精製(シークエンス解析の前に行うことをお勧めします)
- プラスミドDNA溶液に等量の20%PEG/2.5M NaCl溶液を加え、室温に5縲?襯10分放置した後、10縲?襯15分間13000rpmで遠心する。
- 上澄みを取り除き、ペレットを70%エタノールで洗う。ペレットを乾燥させた後、20?lの滅菌水に溶解させる。
- DNAが回収できているかを確認するため、5?l分注し、 2?lのローディングバッファーを加えてから、適切なDNAマーカーを用いて、1.5%TBEアガロースゲルで電気泳動する。
- シークエンス準備完了
□PCR精製方法
適切なプライマーを使いPCRを行うことで、インサートDNAを増幅させることができます。 PCR産物はシークエンス解析を行う前に、スピンカラムかsAP/exo1法(shrimp alkaline phosphatase/exonuclease1)により精製してください。
□参考文献
- Werle. E, Schneider. C, Renner. M, Volker.M and Fiehn. W. (1994) Convenient single-step, one tube purification of PCR products for direct sequencing. Nucl. Acids Res. 22: 4354-4355.
- Hanke. M and Wink. M. (1994) Direct DNA sequencing of PCR-amplified vector inserts following enzymatic degradation of primer and dNTPs. BioTechniques 17: 858-860.
□I.M.A.G.E.ベクター情報一覧
| ベクター | 薬剤耐性 | ベクターマップと塩基配列 |
|---|---|---|
| Lafmid BA | Ampicillin | |
| pAD-GAL4 | Ampicillin | |
| pAMP1 | Ampicillin | |
| pAMP10 | Ampicillin | |
| pBK-CMV | Kanamycin | |
| pBluescribe (modified) | Ampicillin | |
| pBluescript II KS+ | Ampicillin | |
| pBluescript II SK+ | Ampicillin | |
| pBluescript KS+ | Ampicillin | |
| pBluescript SK- | Ampicillin | |
| pBluescript SK+ | Ampicillin | |
| pBluescript FL | Ampicillin | |
| pBluescriptR | Ampicillin | |
| pCDNA3 | Ampicillin | |
| pcDNA3.1 | Ampicillin | |
| pcDNA3.1(-) | Ampicillin | |
| pcDNA3.1Zeo | Ampicillin | |
| pcDNAI | Ampicillin | |
| pcDNAII | Ampicillin | |
| pCMV-SPORT | Ampicillin | |
| pCMV-SPORT2 | Ampicillin | |
| pCMV-SPORT4 | Ampicillin | |
| pCMV-SPORT6 | Ampicillin | |
| pCMV-SPORT6.1 | Ampicillin | |
| pCMV-SPORT6.ccdB | Ampicillin | |
| pCR2.1-TOPO | Ampicillin | |
| pCR3.1 | Ampicillin | |
| pCR4-TOPO | Kanamycin | |
| pCR-BluntII-TOPO | Kanamycin | |
| pCR-XL-TOPO | Kanamycin | |
| pCS105 | Ampicillin | |
| pCS107 | Ampicillin | |
| pCS108 | Ampicillin | |
| pCS111 | Ampicillin | vector information (LLNL) |
| pCS2+ | Ampicillin | |
| pCS22+ | Ampicillin | |
| pCS2G | Ampicillin | |
| pDNR-Dual | Ampicillin | |
| pDNR-LIB | Chloramphenicol | |
| pDONR201 | Kanamycin | |
| pDONR223 | Spectinomycin | |
| pExpress-1 | Ampicillin | |
| pME18S-FL3 | Ampicillin | |
| pOTB7 | Chloramphenicol | |
| pOTB7-3 | Chloramphenicol | |
| pOTB7a | Chloramphenicol | |
| pPCR-Script Amp SK(+) | Ampicillin | |
| pRKW2 | Ampicillin | |
| pSPORT1 | Ampicillin | |
| pSPORT2 | Ampicillin | |
| pT7T3D-PacI | Ampicillin | |
| pUC19 | Ampicillin | |
| pYX-Asc | Ampicillin | |
| pZERO-2 | Kanamycin | |
| pZL-1 | Ampicillin |
□I.M.A.G.E.情報リンク一覧
-
□The I.M.A.G.E. Consortium
-
□I.M.A.G.E. Query tool
MGCクローンを含むI.M.A.G.E.クローンの情報を検索できます。
-
□Mammalian Gene Collection
MGCライブラリーの内容と完全長cDNAクローンを得る方法について、詳細が公開されています。
-
□dbEST
配列決定されたI.M.A.G.E.クローンを含む全てのESTを検索できます。
-
□Translate tool
クローンを受け取ったときにI.M.A.G.E. IDからclone nameを調べるためのツールです。複数のIDを一度に検索できます。
-
□Plate conversion tool
clone nameからI.M.A.G.E. IDを検索できます。
http://www.geneservice.co.uk/products/tools/PlateConversion.jsp